
Hypoglycémies chez le sujet non diabétique :quand faut-il réaliser une épreuve ?
- Par adrenaline
- 11464 vues
Hypoglycémies chez le sujet non diabétique :quand faut-il réaliser une épreuve ?
Points essentiels
Alors que l'hypoglycémie chez le sujet non diabétique est un évènement rare, il s'agit d'un motif fréquent de consultation. La présence de la triade de Whipple permet d'affirmer la réalité de l'hypoglycémie. Si la glycémie veineuse ainsi que les paramètres reflétant la sécrétion insulinique n'ont pas pu être prélevés lors d'une hypoglycémie spontanée, l'épreuve de jeûne de 72 heures reste le test de référence permettant, d'une part, d'affirmer de façon certaine la réalité de l'hypoglycémie, et d'autre part, d'avancer dans le diagnostic étiologique. Avant de réaliser ce test coûteux et éprouvant, les situations évidentes pourvoyeuses d'hypoglycémies doivent être éliminées : iatrogénie, insuffisance surrénalienne, contexte néoplasique évident, insuffisance multiviscérale, dénutrition sévère. . . Lors d'une hypoglycémie ( 0,45 g/L), une insuliné-mie 3 mUI/L, un C-peptide 0,6 ng/mL, une proinsulinémie 5 pmol/L associée à une concentration plasmatique de bêtahydroxybutyrates 2700 mmol/L permettront d'affirmer la sécrétion inappropriée d'insuline. L'absence d'hypoglycémie au terme du jeûne permettra, dans l'immense majorité des cas, d'éliminer l'hypoglycémie organique.
L'hypoglycémie chez le sujet non diabétique : un évènement rare
L'hypoglycémie chez le sujet non diabétique est un évènement rare en raison de la présence de mécanismes robustes de contrerégulation glycémique. En effet , physiologiquement, une diminution de la glycémie entraîne très rapidement une diminution de la sécrétion d'insuline associée à une augmentation de la sécré-tion de glucagon. Les autres hormones hyperglycémiantes telles que l'hormone de croissance et le cortisol sont également impliquées dans les mécanismes de réponse à l'hypoglycémie. Ce n'est que lorsque ces mécanismes sont dépassés que les symptômes d'hypoglycémie apparaissent .
L'hypoglycémie du sujet non diabétique est paradoxalement un motif de consultation très fréquent . L'hypoglycémie est en effet facilement évoquée par les patients ou leurs médecins. Il est donc indispensable dans un premier temps d'affirmer l'hypoglycémie.
Quand peut-on parler d'une hypoglycémie chez le sujet non diabétique ?
On ne peut parler d'hypoglycémie chez le sujet non diabétique que lorsque la triade de Whipple est présente . Cette triade associe :
triade de whipple:
-des symptômes évocateurs d'hypoglycémie ;
-une glycémie veineuse inférieure à 0,55 g/L ;
-la disparition de la symptomatologie après resucrage.
La découverte chez un sujet non diabétique d'une baisse significative de la glycémie isolée, non associée à une symptomatologie clinique n'est pas suffisante à elle seule pour affirmer avec certitude la réalité d'une hypoglycémie. Une hypoglycémie isolée doit cependant être prise en considération, une fois les artefacts de mesure éliminés (cf. infra). En effet, le seuil de glycémie entraînant des symptômes cliniques est souvent très bas chez les patients présentant une hypoglycémie organique.Nous allons détailler dans les lignes suivantes les trois paramè-tres qui, lorsqu'ils sont associés, définissent la triade de Whipple.
Les symptômes évocateurs d'une hypoglycémie:
Les symptômes évocateurs d'une hypoglycémie sont les mêmes que ceux présentés par le sujet diabétique. Ils sont divisés en deux catégories : les signes végétatifs, d'une part, et les signes neuroglycopéniques, d'autre part. Les signes végétatifs sont
classiquement les premiers à apparaître, même s'ils peuvent être absents chez les patients avec une hypoglycémie organique. Ils sont médiés par l'activation du système nerveux sympathique, adrénergique et cholinergique. Ils peuvent associer des palpitations, des tremblements, de l'anxiété, une fringale, des sueurs et des paresthésies.
Les signes neuroglycopéniques sont secondaires à une carence en glucose au niveau du système nerveux central. Ils peuvent associer un syndrome confusionnel, des crises convulsives, des troubles de la vision, une diplopie, une dysarthrie, des troubles de la conscience et au maximum un coma. Si les signes neuroglycopéniques sont présents, ils imposent le dosage de la glycémie et la recherche d'une hypoglycémie organique.
La glycémie veineuse inférieure à 0,55 g/L
Il est indispensable d'obtenir une glycémie veineuse et non simplement une glycémie capillaire. La mesure du glucose sur sang capillaire, simple à réaliser, peut certes orienter vers le niveau glycémique, mais ne constitue pas une preuve d'hypoglycémie chez un sujet non diabétique. Afin d'éviter une activation in vitro de la glycolyse potentiellement responsable d'une baisse artéfactuelle de la glycémie, on préconise l'utilisation d'agents anti-glycolytiques pour le prélèvement (tube fluoro-oxalaté, bouchon gris).
Un seuil de glycémie à 0,55 g/L (3,0 mmol/L) a été adopté par certains pour évoquer le diagnostic d'hypoglycémie [3]. Il faut toutefois souligner qu'une glycémie inférieure au seuil de 0,45 g/L (2,5 mmol/L) aura une bien meilleure spécificité pour le diagnostic d'hypoglycémie organique.
La disparition des symptômes après resucrage
Il s'agit d'un signe important de la triade de Whipple même s'il doit être pris avec précaution. En effet, il est indispensable de garder en mémoire que le sucre est un placebo puissant et qu'il peut parfois permettre une résolution des malaises non hypoglycémiques. Le caractère rapide de la disparition des malaises après resucrage est un paramètre évocateur d'hypoglycémie.
Faire ou ne pas faire l'épreuve de jeûne ?
L'épreuve de jeûne est l'examen de référence de l'exploration de l'hypoglycémie du sujet non diabétique. Elle a deux objectifs. Elle pourra tout d'abord permettre, chez les patients pour lesquels une hypoglycémie spontanée n'a pas pu être authentifiée,d'objectiver la réalité de l'hypoglycémie. Elle pourra permettre ensuite de comprendre le mécanisme de l'hypoglycémie et sera donc très précieuse pour avancer dans le diagnostic étiologique. Il s'agit cependant d'un test long, coûteux, éprouvant et il est donc indispensable de savoir le prescrire à bon escient.
Des traitements peu ven t-ils être responsables des hypog lycémies ?
Avant la réalisation d'une épreuve de jeûne, le premier réflexeà avoir devant des hypoglycémies chez le sujet non diabétique est de détailler sa liste de traitements. De nombreux traitements peuvent, en effet, être responsables d'hypoglycémies même si le niveau de preuve d'imputabilité varie en fonction du traitement [6]. On éliminera bien évidemment tout d'abord la prise d'insuline ou d'insulinosécrétagogues (sulfamides hypoglycé-miants, glinides). Des hypoglycémies secondaires à la prise de traitement comme la quinine, certaines quinolones, la pentamidine, l'indométacine, le lithium, le chloroquinoxaline sulfonamide, le dextropropoxyphène, l'artesunate ont été rapportées. Des hypoglycémies survenant dans les 10 jours après l'instauration d'un traitement par tramadol ont également été décrites. La polymédication augmente le risque d'hypoglycémies iatrogènes. Si une prise de médicaments suspects
d'hypoglycémies est retrouvée, on peut proposer dans un premier temps d'arrêter le médicament suspect en surveillant les glycémies et les signes cliniques.
En revanche, dans les cas exceptionnels de prise cachée d'insuline ou d'insulinosécrétagogues, dans un contexte psychiatrique, une épreuve de jeûne pourra être nécessaire. Cette épreuve de jeune pourra en effet permettre, chez certains patients, d'affirmer le diagnostic d'hypoglycémies par prise cachée d'agents hypoglycémiants. Ainsi, en cas d'administration cachée d'insuline, le C-peptide plasmatique sera le plus souvent indétectable.
Enfin, l'alcool, surtout lorsqu'il est pris de façon massive, à jeun, peut également être responsable d'une hypoglycémie.
Quels sont les horaires des hypoglycémies ?
Une fois les causes iatrogènes éliminées, on sépare classiquement les patients présentant des hypoglycémies à jeun ou à distance des repas des patients présentant des hypoglycémies post-prandiales [7]. Cette classification repose sur l'hypothèse que l'hypoglycémie post-prandiale est plus vraisemblablement d'origine réactive, en rapport avec des troubles fonctionnels alors que l'hypoglycémie pré-prandiale est classiquement majoritairement d'origine organique et nécessite un bilan étiologique complet. Cette hypothèse est le plus souvent vérifiée. Il est cependant indispensable de garder en mémoire que certains patients porteurs d'un insulinome décrivent une symptomatologie exclusivement post-prandiale [8]. Un patient présentant des hypoglycémies exclusivement post-prandiales ne cédant pas au fractionnement alimentaire ou avec des signes neuroglycopéniques doit bénéficier d'une épreuve de jeûne afin d'éliminer une hypoglycémie organique.
Quel est l'état général du patient ?
Au-delà de la différenciation hypoglycémie pré ou post-prandiale, on propose actuellement d'orienter la prise en charge diagnostique en fonction de l'état général du patient. S'il s'agit d'un patient en mauvais état général, on recherchera en première intention, une insuffisance viscérale, qu'elle soit hépatique, rénale ou cardiaque, un sepsis sévère, une dénutrition, une insuffisance en hormones hyperglycémiantes telle que l'insuffisance surrénalienne ou corticotrope ou enfin les volumineuses tumeurs mésenchymateuses sécrétant de l'insulingrowth-factor de type 2 (IGFII) ou ses précurseurs (« big IGFII ») ainsi que les volumineuses tumeurs métastatiques consommatrices de glucose. Le plus souvent, dans cette situation, l'épreuve de jeûne n'est pas l'examen à réaliser en première intention. Les insuffisances viscérales sont en effet facilement diagnostiquées et une cause très fréquente d'hypoglycémie chez le patient hospitalisé. Une insuffisance hépatocellulaire sévère (hépatite
fulminante, foie cardiaque) inhibe les capacités hépatiques de néoglucogenèse. Elle est responsable d'hypoglycémies le plus souvent dans des situations de jeûne. L'insuffisance rénale diminue la clairance de l'insuline et diminue la capacité de mobilisation des précurseurs de la néoglucogenèse. La physiopathologie des hypoglycémies dans l'insuffisance cardiaque reste encore sujette à discussion. Dans le sepsis sévère, l'hypoglycémie est secondaire à une utilisation du glucose majorée par la stimulation des cytokines. L'hypoglycémie dans l'anorexie mentale et plus généralement dans la malnutrition est liée à un défaut de substrats de la néoglucogenèse, mais aussi de la cétogenèse, ce qui en fait toute la gravité. Le déficit en cortisol, que ce soit par une insuffisance corticotrope ou par une insuffisance surrénalienne périphérique peut être responsable d'hypoglycémies lors des jeûnes prolongés. Il est par conséquent conseillé de réaliser très facilement un test vérifiant la bonne fonction surrénalienne avant toute épreuve de jeûne (un test au synacthène par exemple). Certaines tumeurs mésenchymateuses ou épithéliales peuvent synthétiser de l'IGFII mature ou ses précurseurs et être responsables d'hypoglycémies. Le diagnostic peut, là aussi, être le plus souvent affirmé sans l'épreuve de jeûne. Il s'agit en effet le plus souvent de volumineuses tumeurs, souvent de diamètre supérieur à 10 cm,
responsables non seulement de symptômes hypoglycémiques mais également et surtout d'un syndrome tumoral compressif souvent au premier plan. Les hypoglycémies surviennent alors le plus souvent à jeun et sont caractérisées par une sécrétion d'insuline freinée. Au cours de ces hypoglycémies, le C-peptide et l'IGF1 sont bas ou indétectables. Une concentration plasmatique d'IGFII normale ne permet pas d'éliminer le diagnostic et ce n'est parfois que le rapport pro-IGFII/IGFII qui est augmenté.
Une consommation excessive de glucose par la tumeur peut également être retrouvée chez des patients présentant une maladie néoplasique polymétastatique avec un gros volume tumoral (tumeur solide, leucémie à la phase aiguë. . .) [9]. Le diagnostic est souvent fait dans un contexte néoplasique et l'épreuve de jeûne est très souvent inutile.
En revanche, chez un patient en excellent état général, on s'orientera, en première intention, vers une sécrétion inappropriée d'insuline endogène (insulinome ou plus rarement nésidioblastose ou exceptionnellement auto-immunité antiinsuline) ou exogène (prise accidentelle ou cachée d'insuline ou d'un insulinosécrétagogue). L'épreuve de jeûne pourra bien évidemment être évitée dans cette situation, si une hypoglycémie spontanée survient et si, lors de cette hypoglycémie spontanée, le clinicien pense à prélever, avant tout resucrage, au minimum, une glycémie veineuse, une insulinémie, un Cpeptide plasmatique associés en fonction du contexte à une proinsulinémie, un dosage des hypoglycémiants oraux et à desanticorps anti-insuline.
L'épreuve de jeûne : selon quelles modalités ?
Une épreuve de jeûne correspond à un jeûne total. Elle doit être réalisée en milieu hospitalier. Il est proposé de réaliser des prélèvements veineux systématiques toutes les 4 à 6 heures afin d'effectuer le dosage de glycémie veineuse, insulinémie et C-peptide ainsi que de pro-insuline et de bêtahydroxybutyrate plasmatique tant que la glycémie veineuse reste supérieure à 0,60 g/L et toutes les 1 à 2 heures lorsque la glycémie veineuse devient inférieure à 0,60 g/L [3,7,10]. Classiquement, l'épreuve de jeûne est poursuivie pendant 72 heures [4,7]. Il n'y a pas de bénéfice à poursuivre l'épreuve de jeûne au-delà de 72 heures [4]. Certains auteurs ont proposé des épreuves de jeûne plus courtes de 48 heures [11,12]. En effet, 90 à 100 % des patients porteurs d'un insulinome présentent une hypoglycémie dans les 48 premières heures de jeûne [11]. Il a cependant été décrit des patients porteurs d'un insulinome ne présentant des hypoglycémies qu'au troisième jour de jeûne [13,14].
Le consensus français sur l'hypoglycémie du sujet non diabétique propose d'arrêter le jeûne avant 72 heures dans les circonstances suivantes [15] :
s'il y a des manifestations cliniques sévères (perte de connaissance, crise convulsive, manifestations psychiatriques. . .) ;
s'il y a des manifestations évocatrices d'hypoglycémies ou une symptomatologie identique à celle dont se plaignait le patient associée à une glycémie veineuse inférieure à 0,45 g/L
(2,5 mmol/L) ;
s'il y a une hypoglycémie veineuse inférieure à 0,40 g/L même si elle est asymptomatique ;
en cas de manifestations de cétose sévère rendant la poursuite du jeûne difficile associée à un bêtahydroxybutyrate plasmatique supérieur à 2700 mmol/L.
Quel seuil de glycémie choisir pour arrêterle jeûne ?
Comme discuté précédemment, le consensus français propose d'arrêter le jeûne lorsque la glycémie est inférieure à 0,45 g/L en présence de signes cliniques évocateurs d'une hypoglycémie. Le consensus de la société américaine d'endocrinologie propose de fixer la valeur seuil de glycémie à 0,55 g/L (3 mmol/L) et non 0,45 g/L [3]. Il a en effet été montré que, dans une population de volontaires sains, l'insuline, le Cpeptide et la pro-insuline plasmatique étaient freinés pour de telles glycémies [16]. Certains estiment même que, chez des
sujets sains, l'insulinémie et le C-peptide plasmatique sont très proches de zéro dès que la glycémie atteint 0,65 g/L [17]. Cette valeur seuil de glycémie à 0,55 g/L est cependant discutable, non seulement pour affirmer le diagnostic d'hypoglycémie organique, mais également pour affirmer celui d'hypoglycémie organique médiée par l'insuline. En effet, au cours de l'épreuve de jeûne, peu de sujets sains atteignent le seuil glycémique de
0,45 g/L alors que certains peuvent atteindre des glycémies veineuses inférieures à 0,55 g/L [18]. Par ailleurs les publications ayant validé les valeurs seuils d'insuline, C-peptide et proinsuline dans une population de patients porteurs d'insulinome ont utilisé un seuil de glycémie à 0,45 g/L (2,5 mmol/L) [7,8,19]. Enfin, la spécificité des valeurs seuils d'insuline, de C-peptide et de pro-insuline est moindre lorsque la glycémie est supérieure à 0,50 g/L par rapport à une glycémie inférieure [8].
Comment interpréter l'épreuve de jeûne ?
Les insuffisances rénales, hépatiques ou les antécédents de pancréatectomie partielle rendent l'interprétation de l'épreuve de jeûne délicate dans la mesure où les valeurs seuils classiques ne peuvent plus être utilisées [20].
Par ailleurs, les valeurs seuils proposées ci-dessous ne peuvent être interprétées que si elles sont concomitantes à une hypoglycémie veineuse.
Enfin, chaque clinicien doit valider ces valeurs seuils avec son biologiste en fonction des méthodes de dosage utilisées.
L'insulinémie
L'insuline est actuellement dosée dans la majorité des laboratoires grâce à une méthode immunométrique utilisant des anticorps monoclonaux sans réaction croisée significative avec la pro-insuline. La valeur seuil d'insulinémie de 3 mUI/L est proposée par la plupart des auteurs et des consensus [3,15]. Une insulinémie
supérieure ou égale à 3 mUI/L lors d'une glycémie veineuse inférieure ou égale à 0,45 g/L permet en effet d'affirmer le diagnostic de sécrétion inappropriée d'insuline avec une spécificité de 100 %. En revanche, il est important de souligner qu'une insulinémie inférieure ou égale à 3 mUI/L lors d'une
hypoglycémie ne permet pas d'éliminer le diagnostic d'hypo glycémie organique. En effet jusqu'à 35 % des patients avec un insulinome ont des insulinémies inférieures à 3 mUI/L lors d'une hypoglycémie [19,21].
Il est à nouveau important de répéter que cette valeur seuil n'est interprétable qu'en présence d'une hypoglycémie. Ainsi 40 % des sujets contrôles présentent au terme du jeûne une insulinémie supérieure ou égale à 3 mUI/L avec cependant, chez ces sujets, des glycémies qui restent dans les limites de la normale[21].
Classiquement le diagnostic d'injections cachées d'insuline est suspecté lorsque, lors d'une hypoglycémie, on retrouve une insulinémie très élevée associée à un C-peptide freiné. Cela dépend cependant du dosage d'insuline utilisé. En effet certains dosages d'insuline reconnaissent exclusivement l'insuline humaine et ne reconnaissent pas les analogues de l'insuline (insuline lispro, aspart et glargine) [22]. En fonction du dosage
d'insulinémie utilisé, une insulinémie et un C-peptide bas lors d'une hypoglycémie ne permettent pas d'éliminer la prise cachée d'analogues de l'insuline.
Le C-peptide plasmatique
Une valeur seuil de C-peptide de 0,6 ng/mL est proposé par la majorité des auteurs [3,10,15,21]. Le niveau glycémique en regard de cette valeur seuil varie cependant, en fonction des recommandations, entre 0,45 et 0,55 g/L avec une sensibilité et une spécificité du seuil de 0,6 ng/mL de près de 100 % pour le diagnostic de sécrétion inappropriée d'insuline lorsqu'on retient la valeur seuil de glycémie de 0,45 g/L [10,19,21].
Comme pour l'insulinémie, il est à nouveau important de répé-ter que cette valeur seuil n'est interprétable qu'en présenced'une hypoglycémie. Ainsi 90 % des sujets contrôles présentent au terme du jeûne un C-peptide supérieur ou égal à 0,6 ng/mL avec cependant, chez ces sujets, des glycémies qui restent dans les limites de la normale [21].
La proinsulinémie
Deux valeurs seuils de proinsulinémie ont été proposés : 5 et 22 pmol/L.
Certains auteurs ont montré que, pour une glycémie inférieure à 0,45 g/L, une valeur seuil de proinsulinémie de 5 pmol/L a une sensibilité de 100 % [19,21]. En revanche, la spécificité pour ce seuil de 5 pmol/L, évalué au terme du jeûne dans une population contrôle, n'ayant pas atteint ces niveaux d'hypoglycémies, n'est que de 41 % avec de très nombreux faux positifs[21].
D'autres ont parallèlement montré, mais cette fois, quel que soit le niveau de glycémie, qu'une proinsulinémie supérieure à 22 pmol/L, pouvait avoir des sensibilités et spécificités de 100 % [21].
Le bêtahydroxybu tyrate plasmati que (bOH)
Même si des observations contradictoires ont été rapportées
[23], la plupart des études montrent qu'un bêtahydroxybutyrate plasmatique supérieur à 2700 mmol/L, lors d'une glycémie inférieure à 0,60 g/L permet d'éliminer une sécrétion inappropriée d'insuline avec une sensibilité et une spécificité proche de 100 % [8,24].
Dosage des agents insulinos écrétagogues
La recherche de sulfamides hypoglycémiants et de glinides est le seul élément biologique permettant d'affirmer la prise cachée de ces médicaments. La recherche de sulfamides hypoglycémiants doit se faire sur un échantillon sanguin prélevé idéalement lors de l'hypoglycémie ou le plus rapidement possible après l'épisode d'hypoglycémie, dans la mesure où la plupart des sulfamides sont rapidement éliminés du sang après une
prise unique. Le dosage des métabolites urinaires peut être proposé alternativement au plasma.
Dosage des anticorps anti -insuline ou anti-récepteur de l'insuline
La présence d'anticorps anti-insuline est d'interprétation difficile dans la mesure où elle peut, non seulement être le témoin d'une hypoglycémie auto-immune mais également être retrouvée chez des sujets sains voire chez des patients avec un insulinome [25]. L'hypoglycémie auto-immune est une entité rare décrite essentiellement chez des sujets d'origine japonaise [26]. Chez les sujets qui ne sont pas d'origine asiatique, on la décrit essentiellement chez des patients ayant un myélome multiple ou un lupus érythémateux disséminé [27–29]. L'utilisation de traitements tels que le méthimazole a également été rapporté dans la genèse de ces hypoglycémies auto-immunes. Il s'agit classiquement d'hypoglycémies volontiers post-prandiales mais pouvant également survenir à jeun. Les anticorps antiinsuline se fixent sur les molécules d'insuline synthétisées physiologiquement et relarguent cette insuline dans un second temps, sans qu'il n'y ait de lien avec le niveau glycémique du moment. Ces anticorps sont alors responsables d'une hypoglycémie par relargage inappropriée d'insuline. Sur le plan biologique, on observe, outre l'hypoglycémie, une élévation majeure
de l'insuline, du C-peptide et de la proinsulinémie. La responsabilité des anticorps anti-récepteur de l'insuline dans les hypoglycémies est encore plus exceptionnelle puisqu'un nombre très limité de patients avec cette pathologie ont été rapportées dans la littérature mondiale. Il s'agit souvent d'un
contexte particulier : lupus érythémateux disséminé, sclérodermie, cirrhose biliaire primitive, maladie cœliaque, syndrome d'insulinorésistance sévère. . . [30].
Recommandations du consensus de la Société française d'endocrinologie [15]
L'arbre décisionnel est schématisé sur la figure 1. Les recommandations ci-dessous sont applicables, si et seulement si la glycémie concomitante est 0,45 g/L (2,5 mmol/L) :
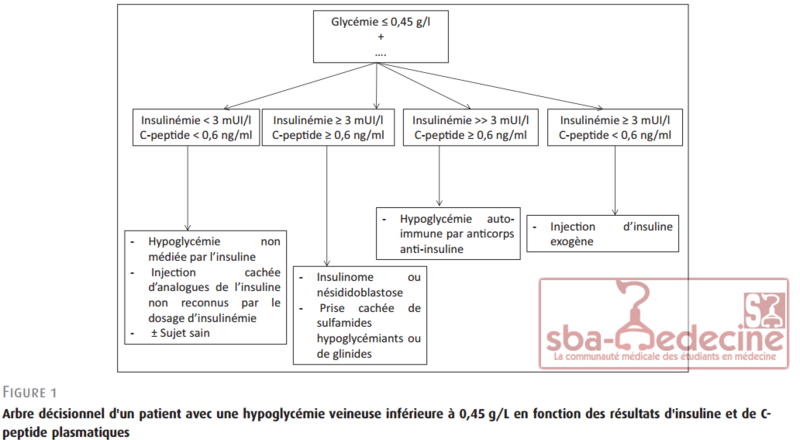
l'association d'une insulinémie inférieure à 3 mUI/L associée à un C-peptide sérique inférieur à 0,6 ng/mL est en faveur soit d'une hypoglycémie non médiée par l'insuline soit d'in jections d'analogue de l'insuline non reconnu par le dosage d'insulinémie. Le diagnostic de sujet sain peut également être évoqué mais doit être posé avec une extrême prudence devant ce bilan dans la mesure où très peu de sujets sains peuvent atteindre ce niveau de glycémie ; l'association d'une insulinémie supérieure ou égale à 3 mUI/L et/ou un C-peptide supérieur ou égal à 0,6 ng/mL est en faveur du diagnostic d'insulinome, c'est-à- dire d'une tumeur endocrine développée aux dépens des cellules bêta de Langherans et sécrétant de l'insuline, ou d'une nésidioblastose, c'est-à-d ire une hyperplasie diffuse ou localisée des cellules bêta de Langherans. Une prise cachée de sulfamides hypo glycémiants ou de glinides sera éliminée par une recherche spécifique, à effectuer sur un prélèvement réalisé au moment de l'hypoglycémie. Si l'insulinémie est très supérieure à 3 mUI/L associée à un C-peptide supérieur à 0,6 ng/mL ou s'il existe un contexte clinique particulier, une hypoglycémie auto -immune, liée à la présence d'anticorps anti-insuline,pourra être envisagée ; l'association d'une insulinémie très supérieure à 3 mUI/L associée à un C-peptide inférieur à 0,6 ng/mL est en faveur du diagnostic d'in jection d'insuline exogène. Exceptionnelle ment la présence d'anticorps anti-récepteur de l'insuline ou l'existence d'une mutation du récepteur de l'insuline peut
donner un tableau biologique proche.
Et s'il n'y a pas d'hypoglycémie au termedu jeûne ?
L'absence de glycémie inférieure à 0,60 g/L permet dans la majorité des cas d'écarter l'hypothèse de malaises hypoglycémiques. Cependant en cas de forte suspicion clinique d'hypo glycémie organique un test au glucagon, une hyperglycémie provoquée par voie orale (HGPO) 75 g pendant 5 heures ou un repas test peuvent être proposés en deuxième intention.
Conclusion
L'épreuve de jeûne de 72 heures reste l'épreuve de référence dans le diagnostic des hypoglycémies du sujet non diabétique.
Elle est réalisée lorsque les causes évidentes d'hypoglycémies ont été écartées et si le dosage des paramètres de la sécrétion insulinique n'a pas pu être réalisé lors d'une hypoglycémie spontanée. Au terme des 72 heures de jeûne, l'absence d'hypoglycémie permet d'écarter dans la majorité des cas l'hypothèse d'une
hypoglycémie organique. Une insulinémie 3 mUI/L associée à un C-peptide 0,6 ng/mL et/ou à une proinsulinémie 5 pmol/L permet d'affirmer le diagnostic de sécrétion inappropriée d'insuline, lorsque la glycémie est inférieure à 0,45 g/L . Un bêtahydroxybutyrate inférieur à 2700 mmol/L au terme du jeûne conforte ce diagnostic. En revanche une insulinémie inférieure à 3 mUI/L lors d'une hypoglycémie ne permet pas d'écarter le
diagnostic de sécrétion inappropriée d'insuline.
Déclaration de liens d'intérêts : les auteurs déclarent ne pas avoir de liens d'intérêts
Références
[1] Whipple A. The surgical therapy of hyperinsulinism. J Int Chir 1938;3:237. [2] Macaron CI, Kadri A, Macaron Z. Nucleated
red blood cells and artifactual hypoglycemia.Diabetes Care 1981;4:113–5.
[3] Cryer PE, Axelrod L, Grossman AB, Heller SR,Montori VM, Seaquist ER, et al. Evaluation and management of adult hypoglycemic disorders: anEndocrineSocietyClinicalPracticeGuideline. J Clin Endocrinol Metab 2009;94:709–28.
[4] Service FJ, Natt N. The prolonged fast. J Clin Endocrinol Metab 2000;85:3973–4.
[5] Marks V. Recognition and differential diagnosis of spontaneous hypoglycemia. Clin Endocrinol 1992;37:309–16.
[6] MuradMH, Coto-YglesiasF, WangAT, Sheidaee N, Mullan RJ, Elamin MB, et al. Clinical review:
drug-induced hypoglycemia: a systematic review. J Clin Endocrinol Metab 2009;94:741–5.
[7] Service F. Hypoglycemic disorders. N Engl J Med 1995;332:1144–52.
[8] Placzkowski KA, Vella A, Thompson GB, Grant CS, Reading CC, Charboneau JW, et al. Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 1987–2007. J Clin Endocrinol Metab 2009; 94:1069–73.
[9] Habra MA, Nunez R, Chuang H, AyalaRamirez M, Rich T, Kyle K, et al. Fatal hypoglycemia in malignant pheochromocytoma: direct glucose consumption as suggested by (18)F-2-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography imaging. Endocrine 2010;37:209–12.
[10] Service F. Diagnostic approach to adults with hypoglycemic disorders. Endocrinol Metab Clin North Am 1999;28:519–32.
[11] Hirshberg B, Livi A, Bartlett DL, Libutti SK, Alexander HR, Doppman JL, et al. Forty-eighthour-fast: the diagnostic test for insulinoma. J Clin Endocrinol Metab 2000;85:3222–6.
[12] Quinkler M, Strelow F, Pirlich M, Rohde W, Biering H, Lochs H, et al. Assessment of suspected insulinoma by 48-hour fasting test: a retrospective monocentric study of 23 cases. Horm Metab Res 2007;39:507–10.
[13] van Bon AC, Benhadi N, Endert E, Fliers E, Wiersinga WM. Evaluation of endocrine tests. D: the prolonged fasting test for insulinoma. Neth J Med 2009;67:274–8.
[14] Service FJ, Dale AJ, Elveback LR, Jiang NS. Insulinoma: clinical and diagnostic features of 60 consecutive cases. Mayo Clin Proc 1976; 51:417–29.
[15] Agin A, Charrie A, Chikh K, Tabarin A, Vezzosi D. Fast test: clinical practice and interpretation. Ann Endocrinol (Paris) 2013;74:174–84.
[16] Hojlund K, Wildner-Christensen M, Eshoj O, Skjaerbaek C, Holst JJ, Koldkjaer O, et al.
Reference intervals for glucose, beta-cell polypeptides, and counter regulatory factors during prolonged fasting. Am J Physiol Endocrinol Metab 2001;280:E50–8.
[17] Heller SR, Cryer PE. Hypoinsulinemia is not critical to glucose recovery from hypoglycemia in humans. Am J Physiol 1991;261:E41–8.
[18] Merimee TJ, Fineberg SE. Homeostasis during fasting. II. Hormone substrate differences between men and women. J Clin Endocrinol Metab 1973;37:698–702.
[19] Vezzosi D, Bennet A, Fauvel J, Caron P. Insulin, C-peptide and proinsulin for the biochemical diagnosis of hypoglycaemia related to endogenous hyperinsulinism. Eur J Endocrinol 2007;157:75–83.
[20] Basu A, Sheehan M, Thompson GB, Service FJ. Insulinoma in chronic renal failure: a case report. J Clin Endocrinol Metab 2002;87: 4889–91.
[21] Guettier JM, Lungu A, Goodling A, Cochran C, Gorden P. The role of proinsulin and insulin in the diagnosis of insulinoma: a critical evaluation of the Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2013;98:4752–8.
[22] Yoshida R, Ohkubo K, Akehi Y, Harada S, Shinohara K, Kawashima H, et al. Clinical application of the different cross-reactivities of anti-insulin antibodies to insulin lispro to evaluate endogenous insulin secretion. Clin Chim Acta 2013;415:250–4.
[23] Buffet A, Vezzosi D, Maiza JC, Grunenwald S, Bennet A, Caron P. Increased plasma betahydroxybutyrate levels during the fasting test in patients with endogenous hyperinsulinaemic hypoglycaemia. Eur J Endocrinol 2013; 169:91–7.
[24] O'Brien T, O'Brien PC, Service FJ. Insulin surrogates in insulinoma. J Clin Endocrinol Metab 1993;77:448–51.
[25] Fushimi H, Tsukuda S, Hanafusa T, Matsuyuki Y, Nishikawa M, Ishihara S, et al. A case of insulin autoimmune syndrome associated with small insulinomas and rheumatoid arthritis. Endocrinol Jpn 1980;27:679–87.
[26] Hirata Y, Uchigata Y. Insulin autoimmune syndrome in Japan. Diabetes Res Clin Pract 1994;24(Suppl.):S153–7.
[27] Redmon B, Pyzdrowski KL, Elson MK, Kay NE, Dalmasso AP, Nuttall FQ. Hypoglycemia due to an insulin-binding monoclonal antibody in multiple myeloma. N Engl J Med 1992;326:994–8.
[28] Halsall D, Mangi M, Soos M, Fahie-Wilson M, Wark G, Mainwaring-Burton R, et al. Hypoglycemia due to an insulin-binding antibody in a patient with an IgA-kappa myeloma. J Clin Endocrinol Metab 2007;92:2013–6.
[29] Blackshear PJ, Rotner HE, Kriauciunas KA, Kahn CR. Reactive hypoglycemia and insulin autoantibodies in drug-induced lupus erythematosus. Ann Intern Med 1983;99:182–4.
[30] Redmon JB, Nuttall FQ. Autoimmune hypoglycemia. Endocrinol Metab Clin North Am 1999;28:603–18. vii.
source: la press médicale
2016 Elsevier Masson SAS. Tous droits réservés.




